Parcours de soin couple de femmes

Les protocoles de traitement de FIV peuvent varier selon le dossier de la patiente. Il n’existe donc pas de protocole unique. Pour vous aider à comprendre le parcours, nous vous proposons un exemple représentatif de ce qui peut vous être proposé.
Pour plus d'informations, nous vous invitons à prendre directement contact avec le laboratoire Eurofins Biologie Médicale le plus proche de chez vous.




Accueil
La consultation au centre
Lors de la 1ère consultation au centre il vous sera demandé d’apporter les documents suivants :
- Projet parental commun (attestation sur l’honneur, certificat de vie commune…) en cas de prise en charge de couple
- Pièces d’identité
- Carte Vitale
- Résultats des derniers bilans de fertilité : prise de sang (hormonologie), imagerie (échographie, hystérographie)…
Vous serez amené à rencontrer différents professionnels de santé.
Le plus souvent vous rencontrerez en première intention un gynécologue. Le gynécologue est le médecin référent du dossier, il suit le couple tout au long de son parcours. Il réalise le bilan initial, certains examens d’imagerie, s’occupe de l’étape de stimulation ovarienne, des gestes de ponction ovarienne et de transfert embryonnaire, et dans certains cas du suivi initial de grossesse.
Vous rencontrerez également les biologistes responsables du laboratoire d’AMP, ainsi que les biologistes du CECOS (banque de sperme) afin de valider la délivrance des paillettes de spermatozoïdes congelés issus d’un donneur. Ils interprèteront les bilans biologiques d’infertilité et valideront l’indication de la technique d’AMP avec le gynécologue. Les biologistes mettent en œuvre avec leur équipe technique l’ensemble des étapes d’une tentative : préparation des gamètes, mise en fécondation, culture et évaluation des embryons, transfert et/ou cryopréservation des embryons. Ils s’assurent au quotidien de l’excellence de la prise en charge au laboratoire et travaillent en étroite collaboration avec le gynécologue dans le cadre d’une prise en charge multidisciplinaire.
Avant une ponction ovarienne ou tout autre acte chirurgical vont rencontrerez un médecin anesthésiste. L’anesthésiste au cours de la consultation évaluera vos risques opératoires et choisira la technique anesthésique et le suivi postopératoire les plus appropriés à votre état de santé et à l'intervention prévue.


Diagnostic
Quels examens doit-on réaliser pour notre prise en charge ?
Les examens qui vous seront prescrits sont soit à visée diagnostique (explorer votre fertilité et rechercher la(les) cause(s) pouvant expliquer vos difficultés de conception) soit réglementaires (examens obligatoires avant toute prise en charge en AMP).
Il s’agit d’un exemple, le bilan peut évoluer en fonction du contexte et sera évalué par votre médecin.
Bilan Initial pour la femme :
- Bilan hormonal :le bilan hormonal est réalisé au 3ème jour du cycle menstruel et une partie peut être prescrite au 23ème jour. Ce bilan nous donne des indications sur l’état de votre réserve ovarienne mais également sur votre ovulation et nous permettent d’adapter au mieux le traitement de stimulation qui vous sera proposé.
- Échographie ovarienne :l’échographie des ovaires est réalisée au 3ème jour du cycle menstruel et permet de déterminer le compte folliculaire antral (CFA). Ce compte permet de nous donner des indications sur l’état de votre réserve ovarienne.
- Examen des trompes :cet examen permet d’évaluer la perméabilité des trompes, de rechercher une éventuelle pathologie de la cavité utérine ou une malformation utérine.
- Test de dépistage des maladies sexuellement transmissibles :VIH, Hépatite B, Hépatite C,…
- Explorations complémentaires (examen génétique, examen d’imagerie) :ces analyses vous seront prescrites en cas d’anomalies retrouvées.
Tests de biologie médicale spécialisée
Le laboratoire de biologie médicale ultraspécialisé Eurofins Biomnis est partenaire des centres d’AMP et de spermiologie afin de leur apporter son expertise biologique la plus innovante. De nombreux tests sont proposés par Eurofins Biomnis :
- Caryotype moléculaire constitutionnel (SNP Array) pré- et postnatal
- Syndrome de l’X fragile
- Délétion du chromosome Y
- Disjonction chromosomique
- Exome
- Bilans initiaux : hormones stéroïdiennes, AMH, Inhibine…
- Bilans de suivi de stimulation
- Anticoagulant circulant (ACC)
- Anticorps anticardiolipine
- Anticorps Anti-bêta2 glycoprotéine 1 (B2GP1)
- Protéine S – protéine C – antithrombine
- Facteur V Leiden
- Facteur II – Prothrombine
- Recherche de la mutation du gène MTHFR (Méthylenetetrahydrofolate reductase)
- Homocystéine
- Marqueurs sériques de dépistage de la trisomie 21
- Ninalia – Dépistage prénatal non invasif des trisomies 13, 18 et 21 (DPNI ou ADN lc)
- Génotypage du Rhésus D fœtal (GRHDF)
- Dépistage de la pré-éclampsie du 1er trimestre et du 2ème trimestre
- Cytomégalovirus (CMV)
- Herpès (HSV)
- Toxoplasmose
- Zika
- Haemophilus ducreyi
- Mycoplasma genitalium
- Recherches de pathogènes dans les différentes infections génitales…


Traitement
Le choix de la technique d’AMP est effectué au cas par cas, au sein d’une équipe pluridisciplinaire (gynécologues, biologistes…), qui évalue les chances de grossesse naturelle et de succès en AMP, le délai souhaitable pour la prise en charge, ainsi que les risques éventuels.
Ce choix vous sera exposé, et vous disposerez d’un délai de réflexion d’un mois pour confirmer votre consentement écrit.
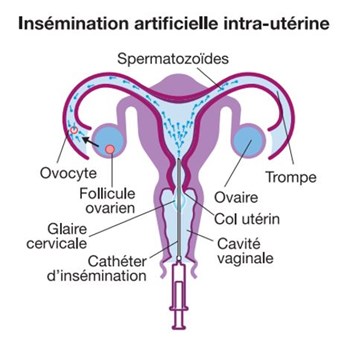
L’insémination intra-utérine avec sperme de donneur (IIU-D)
L’insémination intra-utérine (ou insémination artificielle) avec sperme de donneur consiste à reproduire un cycle naturel à l’aide d’injections hormonales afin de permettre le développement puis l’ovulation d’un follicule (parfois deux), et de synchroniser cette dernière avec le dépôt de spermatozoïdes de donneur dans la cavité utérine, qui remonteront ensuite dans les trompes jusqu’à l’ovule.
La phase de stimulation démarre en début de cycle et dure une dizaine de jours, au cours desquels votre gynécologue contrôlera la croissance et la maturité folliculaire, ainsi que l’aspect de l’endomètre, par échographie et prise de sang. Lorsque les critères de déclenchement seront atteints, une dernière injection permettra de provoquer l’ovulation et de programmer l’insémination (environ 36 heures plus tard).
Le jour de l’insémination, la décongélation et le traitement des spermatozoïdes au laboratoire permet de les sélectionner et les « activer » en reproduisant les mécanismes naturels de sélection et capacitation.
NB : les spermatozoïdes de donneur sont congelés sous forme de paillette au CECOS et doivent être préalablement importés dans le centre d’AMP par la patiente receveuse.
Lorsque la préparation de sperme est terminée, celle-ci est placée dans un cathéter souple, qui permet au gynécologue de déposer les spermatozoïdes dans la cavité utérine en passant par le col, à l’aide d’un spéculum, en position gynécologique. Cette étape d’insémination est un geste simple et indolore, effectué par voie naturelle, sans anesthésie préalable.
Après l’insémination, vous pouvez reprendre une vie normale, sans recommandations ni restrictions particulières. Une prise de sang (dosage d’HCG) vous sera demandée environ 2 semaines plus tard afin d’évaluer une implantation éventuelle et le succès de la tentative.
La fécondation in vitro avec sperme de donneur (ICSI-D)
La fécondation in vitro consiste à concevoir un ou plusieurs embryons à l’extérieur du corps de la femme. Pour cela, il faut stimuler fortement les ovaires à l’aide d’injections hormonales afin de permettre le développement de plusieurs follicules simultanément, puis de prélever chirurgicalement les ovules qu’ils contiennent afin de les féconder par des spermatozoïdes au laboratoire.
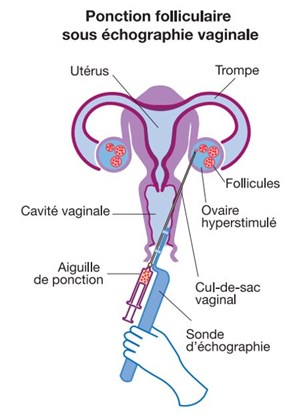
La phase de stimulation démarre en début de cycle, précédée ou non d’une phase de blocage de l’ovulation, et dure une dizaine de jours, au cours desquels votre gynécologue contrôlera la croissance et la maturité folliculaire, ainsi que l’aspect de l’endomètre, par échographie et prise de sang. Lorsque les critères de déclenchement seront atteints, une dernière injection permettra de provoquer l’ovulation (nécessaire pour une maturité optimale des ovocytes) et de programmer la ponction des follicules (environ 36 heures plus tard).
La ponction folliculaire est réalisée par le gynécologue, à l’aide d’une sonde échographique par voie vaginale, sous analgésie ou anesthésie (générale ou locale). Le contenu des follicules est aspiré, et les liquides folliculaires sont transmis au laboratoire pour la recherche des ovules au microscope.
NB : tous les follicules ne contiennent pas nécessairement un ovocyte, et tous les ovocytes ne sont pas fécondables.
Le jour de la ponction, la décongélation et le traitement des spermatozoïdes au laboratoire permet de les sélectionner et les « activer » en reproduisant les mécanismes naturels de sélection et capacitation.
NB : les spermatozoïdes de donneur sont congelés sous forme de paillette au CECOS et doivent être préalablement importés dans le centre d’AMP par la patiente receveuse.
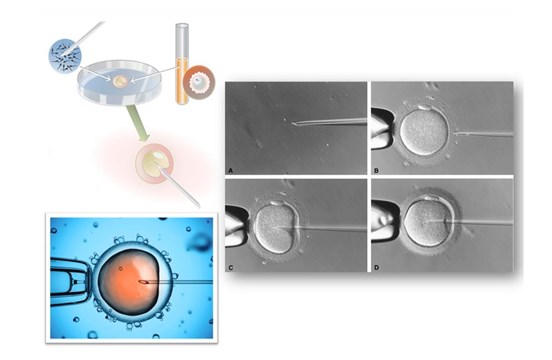
Seule la technique de fécondation in vitro avec micromanipulation (ICSI) est envisageable avec des spermatozoïdes décongelés.
La fécondation des ovocytes s’effectue par injection directe d’un spermatozoïde dans chaque ovocyte mature obtenu à l’issu de la ponction. Le spermatozoïde est sélectionné visuellement selon son aspect et sa mobilité, afin d’optimiser les chances de fécondation. Les ovocytes injectés sont ensuite mis à incuber dans des conditions proches de l’environnement naturel, à 37°C.
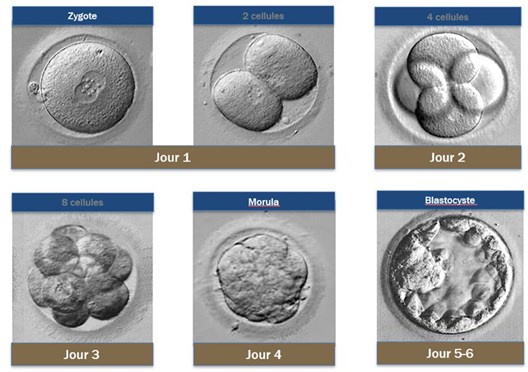
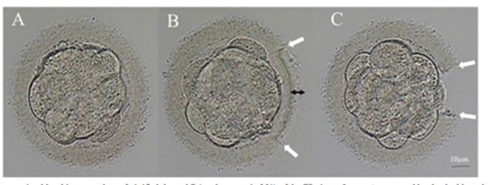
Le succès de la fécondation est évalué dès le lendemain de la ponction, à J1, par la présence de deux noyaux (l’un provenant de l’ovocyte, l’autre du spermatozoïde). Dans les jours qui suivent, en cas de développement embryonnaire normal, le nombre de cellules est multiplié par 2 toutes les 24h.
Le biologiste peut être amené à vous contacter par téléphone au cours de cette période pour vous informer du nombre et de la qualité des embryons.
Le stade de transfert embryonnaire, soit le moment où l’embryon sera replacé dans l’utérus, dépend du contexte médical et des pratiques de votre centre. Il peut s’agir :
- D’un transfert précoce (vers J2 ou J3), au stade clivé
- D’une culture prolongée (vers J5 ou J6), au stade de blastocyste
Le choix de l’embryon à transférer est effectué par le biologiste et sur des critères morphologiques afin d’optimiser les chances d’implantation. Afin de limiter les complications liées aux jumeaux et aux grossesses multiples, le transfert d’un embryon unique est largement favorisé ; dans le cas contraire, le choix devra être justifié médicalement avec consentement éclairé du couple.
Au moment du transfert, l’embryon est placé dans un cathéter souple, qui permet au gynécologue de le déposer dans la cavité utérine en passant par le col, à l’aide d’un spéculum, parfois sous contrôle échographique. Cette étape de transfert est un geste simple et indolore, effectué par voie naturelle, sans anesthésie préalable.
Après le transfert, vous pouvez reprendre une vie normale, sans recommandations ni restrictions particulières, en respectant le traitement prescrit par votre gynécologue. Une prise de sang (dosage d’HCG) vous sera demandée une dizaine de jours plus tard afin d’évaluer une implantation éventuelle et le succès de la tentative.
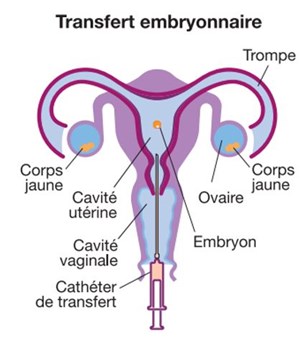
NB : en cas d’absence de transfert embryonnaire (absence d’ovocyte utilisable le jour de la ponction, échec de fécondation, ou échec de culture embryonnaire), la tentative de FIV n’est pas décomptée par la sécurité sociale. Vous devrez alors prendre rendez-vous avec votre gynécologue pour faire le point sur la suite de votre parcours.
Dans certains cas, vos embryons pourront être conservés par congélation :
- Lorsqu’un transfert frais n’est pas envisageable (risque d’hyperstimulation, endomètre ou progestérone inadéquats, attente d’examens complémentaires…)
- Lorsqu’un ou plusieurs embryon(s) non transféré(s) (ou « surnuméraire(s) ») s’avèrent de bonne qualité.
La technique employée est appelée vitrification : il s’agit d’un refroidissement ultra-rapide de l’embryon de 37°C à -196°C qui, à l’aide d’un milieu cryoprotecteur, pourra être mis au repos puis conservé sous forme de paillette, plongée dans une cuve d’azote liquide, et sans limite de durée.

En cas de nouveau transfert, une simple surveillance voire préparation de l’endomètre pour l’implantation sera nécessaire (par comprimés ou injections), avant de programmer une date pour le transfert d’un embryon congelé (TEC). Un consentement de décongélation embryonnaire devra être signé par le couple.
Lors de la décongélation, et avant le transfert, l’embryon retrouvera dans la grande majorité des cas sa capacité de développement dans la grande majorité des cas ; il existe cependant des cas d’échec de décongélation, qu’il reste difficile de prédire.
L’étape du transfert s’apparente ensuite en tous points à un transfert d’embryon frais.
Selon le contexte médical et les pratiques de votre centre, certaines techniques biologiques « innovantes » pourront vous être proposées, nous vous invitons à vous rapprocher des biologistes de votre centre.
a) Sélection des spermatozoïdes pour ICSI à fort grossissement (IMSI)
L’IMSI (ou Intracytoplasmic Morphologically-selected Sperm injection) consiste à observer les spermatozoïdes à un grossissement x6000 minimum (contre x400 pour une ICSI classique), afin de sélectionner et injecter ceux dépourvus de vacuoles au niveau de la tête.
Cette technique peut être proposée après plusieurs échecs de FIV ou des fausses couches.

b) Suivi morphocinétique par la technologie « Time lapse »
Le time lapse consiste à suivre le développement embryonnaire en temps réel à l’aide d’un dispositif de caméras intégrées à l’incubateur. Ce système permet ainsi de visualiser l’intégralité du développement embryonnaire, tout en limitant les variations environnementales pour les embryons par ouverture de l’incubateur.
Cette technique peut être proposée en cas d’échec de culture embryonnaire.
c) Eclosion assistée par laser
L’éclosion assistée, ou « hatching », consiste à faciliter la sortie de l’embryon de sa « coquille », appelée zone pellucide, en l’affinant ou la perçant à l’aide d’un dispositif laser, sous contrôle microscopique.
Cette technique peut être proposée après plusieurs échecs d’implantation ou pour les embryons décongelés.


Suivi
Le premier test de grossesse (dosage d’HCG) est réalisé environ 16 jours après le déclenchement de l’ovulation, soit environ 2 semaines après une insémination, et une dizaine de jours après un transfert d’embryon.
- En cas de négativité : vous devrez contacter votre gynécologue pour discuter de l’ensemble de la tentative et de la suite de la prise en charge.
NB : si vous avez des embryons congelés, leur transfert au cours d’un prochain cycle ajoutera des chances de grossesse sans décompter de tentative supplémentaire.
- En cas de positivité : le dosage d’HCG pourra être répété afin de suivre son évolution, tout en poursuivant le traitement de soutien prescrit par votre gynécologue. La première échographie vous sera proposée après 1 mois environ, afin d’évaluer l’activité cardiaque du ou des embryon(s) implanté(s), et de s’assurer de l’absence de complication éventuelle (fausse couche, grossesse extra-utérine).
Dans la majorité des cas, les grossesses se déroulent normalement. Il est cependant important de communiquer à votre sage-femme ou votre obstétricien le mode de conception par assistance médicale à la procréation afin de mettre en place un suivi spécifique si nécessaire.


 Parcours de soin
Parcours de soin
 Notre Expertise
Notre Expertise
 Biologie Médicale
Biologie Médicale













